Định luật bảo toàn điện tích là một công cụ hỗ trợ cực mạnh giúp chúng ta có thể giải quyết một cách nhanh chóng các dạng bài tập hóa học. Vậy định luật này được hiểu như thế nào? Làm sao để có thể áp dụng được nó?… Những câu hỏi liên quan sẽ được chúng tôi giải đáp trong nội dung bài viết sau.
Giới thiệu về định luật bảo toàn điện tích
Định luật bảo toàn điện tích có nội dung rằng trong mỗi phản ứng oxi hóa khử xảy ra thì tổng số mol e mà chất khử cho sẽ bằng với tổng số mol e mà chất oxi hóa nhận. Chúng ta có thể áp dụng định luật này trong việc lập các phương trình liên hệ để giải bài tập.
Sở dĩ định luật này được hình này cũng được dựa vào sự cấu tạo của nguyên tử trên phương diện điện. Thường trong mỗi nguyên tử sẽ được cấu tạo bởi hạt nhân mang điện tích dương và các hạt electron mang điện âm chuyển động liên tục xung quanh hạt nhân. Đặc biệt, ở hạt nhân sẽ được cấu tạo bởi hạt proton mang điện dương và hạt nơtron không mang điện. Và số lượng hạt p (proton) ở hạt nhân đúng bằng số e (electron) chuyển động xung quanh.
Định luật điện tích đã chỉ ra rằng: “trong một hệ cô lập về điện tích thì tổng đại số các điện tích là không đổi”. Với hệ cô lập về điện tích có thể được hiểu là hệ không có sự trao đổi với các vật khác nằm bên ngoài hệ.
Một vài hệ quả trong bảo toàn điện tích
Khi nghiên cứu về định luật bảo toàn điện tích, người ta đã tìm được 3 hệ quả sau:
Hệ quả 1
Trong 1 dung dịch thì tổng điện tích dương x số mol ion dương sẽ bằng với tổng điện tích âm x số mol ion âm. Ví dụ nếu đề bài cho 1 dung dịch có chứa a mol Mg2+, b mol K+, c mol SO42-, d mol Cl- và e mol NO3-. Thì khi áp dụng hệ quả 1 thì ta sẽ tìm được 1 phương trình biểu diễn sự liên hệ của những chất này như sau: 2a + b = 2c + d + e.
Hệ quả 2 của định luật bảo toàn điện tích
Trong các phản ứng trao đổi thì tổng điện tích dương x số mol ion dương tham gia phản ứng sẽ bằng tổng điện tích âm x số mol ion âm phản ứng. Ví dụ với bài toán cho từ từ V lít HCL 1M vào 100ml dung dịch có chứa KHCO3 0,5M và Na2CO3 1M đến khi không còn khí thoát ra nữa thì sẽ dừng lại. Đề bài yêu cầu tính V.
Từ đề bài ta có thể tính được số mol của CO3 2- sẽ bằng với số mol Na2CO3 = 0,1 mol và số mol của HCO3- sẽ bằng 0,05 mol. Như vậy, khi áp dụng hệ quả 2 của định luật ta sẽ tìm được mối liên hệ như sau 1 x nH+ = 1 x nHCO3- + 2x nCO32- = 0.25. Từ đó ta có thể tìm ra được nHCl = nH+ = 0.25 mol. Từ đây ta có thể dễ dàng tính được V.
Hệ quả 3
Trong trường hợp thay thế ion thì ta sẽ được: số mol ion lúc đầu x giá trị điện tích của nó sẽ bằng với số mol ion thay thế x điện tích của nó. Giả sử khi cho 0.075 mol Fe2CO3 phản ứng cùng với 150 ml HCl nồng độ aM. Đề bài yêu cầu tính a.
Hướng giải của bài tập này khá đơn giản, trước tiên bạn cần bảo toàn nguyên tố oxi để tìm được số mol của O2-. Khi Fe203 phản ứng với HCl để tạo thành FeCl3 thì nguyên tố oxi trong oxit đã được thay thế bằng Cl-. Như vậy ta sẽ được hệ thức: nCl-= 2nO2-. Từ đó có thể suy ra được nHCl.
Ưu điểm đặc trưng của định luật bảo toàn điện tích
Để tìm được ra ưu điểm của định luật này thì chúng ta hãy cùng nhau đi đến ví dụ cụ thể để từ đó có thể đưa ra được những kết luận khách quan nhất. Bài tập như sau: Cho một hỗn hợp gồm 2 chất có tỷ lệ mol là 1:1 vào một bình có chứa Ba(HCO3)2 thì thu được kết tủa X và dung dịch Y. Nếu thêm từ từ HCL 0,5M vào bình cho đến khi không thấy khí thoát ra thì thấy hết 560ml. Biết dung dịch Y phản ứng vừa đủ với 0,2 mol NaOH. Yêu cầu tính khối lượng kết tủa.
Có thể thấy đây cũng là một bài tập nâng cao. Nếu thực hiện giải theo cách thông thường thì chúng ta sẽ cần phải gọi ẩn và lập rất nhiều phương trình phản ứng hóa học để có thể tìm ra được mối liên hệ về số mol giữa các chất. Mặc dù không quá khó hiểu nhưng đòi hỏi trình bày dài dòng và mất khá nhiều thời gian.
Nếu thực hiện giải bài tập này theo hướng bảo toàn điện tích thì bạn sẽ không cần phải mất công trong việc viết các phương trình phản ứng. Từ đó ta có thể dễ dàng đi đến kết quả của bài toán. Với ví dụ trên, ta có thể thấy ưu điểm của định luật này là giúp người học tiết kiệm được đáng kể thời gian khi làm bài bằng việc hạn chế phải viết các phương trình phản ứng.

Bảo toàn điện tích được áp dụng trong phạm vi nào
Khi áp dụng định luật về bảo toàn điện tích sẽ giúp bạn có thể giải quyết được nhiều dạng bài tập trong cả hóa vô cơ và hữu cơ mà đặc biệt là phản ứng oxi hóa khử. Để có thể áp dụng được thành thạo định luật này thì bạn cần hiểu được bản chất của các phản ứng. Phạm vi áp dụng định luật này thường là một số những dạng bài tập sau:
- Bài tập phản ứng trao đổi ion trong dung dịch các chất điện ly.
- Dạng bài tập khi cho khí cacbonic tác dụng với dung dịch có chứa hỗn hợp các chất bazơ.
- Dạng bài cho từ từ dung dịch chứa ion H+ vào hỗn hợp dung dịch có chứa ion CO32- hoặc có chứa cả hai ion CO32- và HCO3-.
- Bài tập khi cho dung dịch axit tác dụng với ion [Al(OH)4]-.
- Phản ứng của các kim loại, oxit hoặc muối khi tác dụng với các dung dịch axit có hoặc không có tính oxi hóa.
Vận dụng một số bài tập có sử dụng bảo toàn điện tích
Nếu bạn muốn có thể vận dụng thành thạo định luật bảo toàn điện tích trong quá trình giải toán thì cần phải thường xuyên làm bài tập có liên quan để gia tăng khả năng phản xạ. Sau đây là một số bài tập và lời giải có áp dụng định luật này bạn có thể tham khảo:
Ví dụ 1: Hòa tan 10 gam hỗn hợp X gồm Mg và Fe cùng dung dịch HCl 2M. Sau khi phản ứng kết thúc ta thu được dung dịch Y và 5.6 lít H2. Để cation kết tủa hoàn toàn trong Y ta cần 0,6 mol NaOH. Tính V HCl.
Trước hết, ta có thể thấy với bài tập này thì nNa = nOH-=0.6 mol. Vì thế, khi cho NaOh vào dung dịch Y ( có các ion Fe2+, H+ dư, Cl-, Mg2+). Lúc này các ion dương sẽ tác dụng với OH- để tạo kết tủa. Như vậy, sau phản ứng dung dịch chỉ còn Na+ và Cl-. Theo hệ quả 1 thì NaCl-=Na+=0.6 mol. Từ đó suy ra nHCl= 0.6 mol. Vậy thể tích HCl là 0.3 lít.
Ví dụ 2: Một dung dịch chứa 4 ion gồm: 0.01 mol Na+, 0.015 mol SO42-, 0.02 mol Mg2+, x mol Cl-. Tìm giá trị của x. Đây được coi là dạng bài cơ bản nhất trong số các dạng bài có sử dụng bảo toàn điện tích. Khi áp dụng ĐLBTĐT ta có: nNa+ + 2n Mg2+ = 2 nSO42- + nCl-. Như vậy kết hợp với dữ kiện đề bài cho ta sẽ tìm được x=0.02.
Kết luận
Qua bài viết trên chắc hẳn bạn cũng đã phần nào nắm được những nội dung cơ bản nhất về định luật bảo toàn điện tích trong việc giải quyết các bài tập hóa học. Hy vọng với những chia sẻ đó sẽ giúp bạn tự tin hơn trong quá trình làm hóa của mình.


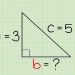






 Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
