Phản ứng oxi hóa khử là gì? Ví dụ về phản ứng oxi hóa khử lớp 10? Đây là hai câu hỏi mà các bạn học sinh gửi về cho giaoduchocduong24h.net nhiều nhất trong tuần vừa qua. Chính vì thế, ngày hôm nay chúng ta sẽ cùng tìm hiểu xoay quanh chủ đề phản ứng oxi hóa khử trong bài viết dưới đây.
1. Phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử là một phản ứng hóa học có sự chuyển electron giữa các chất tham gia vào phản ứng. Hiểu một cách đơn giản, đây là phản ứng khiến một số nguyên tố thay đổi số oxi hóa.
Phản ứng này gồm có những chất sau:
- Chất khử (nhường electron)
- Chất oxy hóa
- Quá trình nhường electron (oxi hóa)
- Quá trình nhận electron (khử)
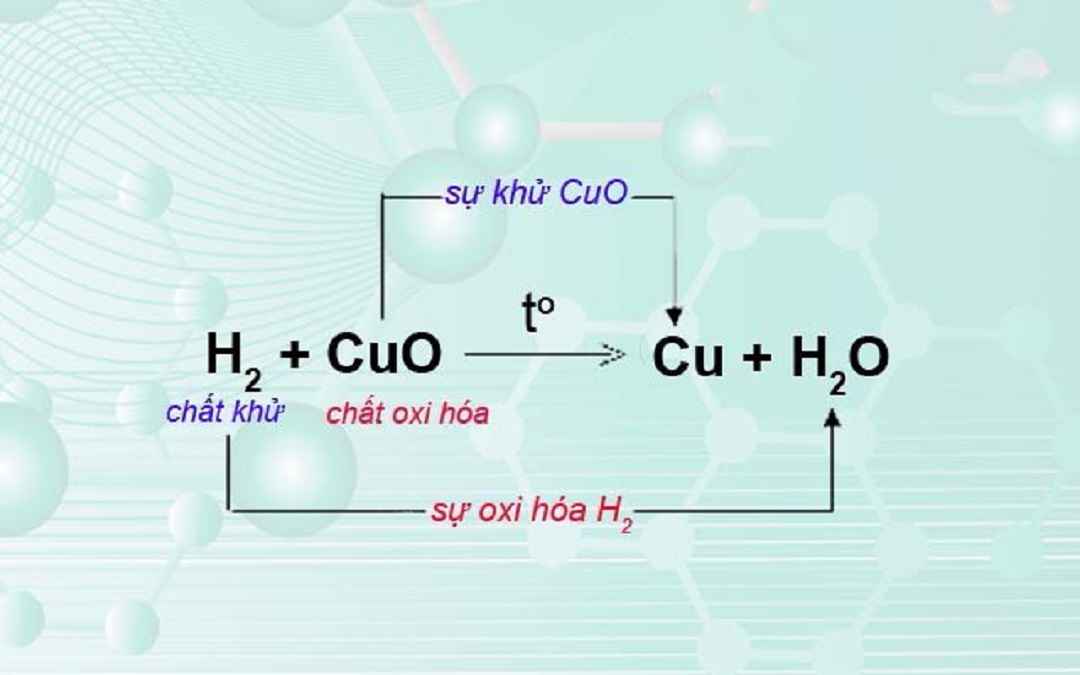
Ví dụ phản ứng oxi hóa sau: Fe + CuSO4 -> Cu + FeSO4
Quá trình thay đổi số oxi hóa: Fe0 → Fe2+ + 2e, FCu2+ + 2e → Cu0
Trong phản ứng này, các chất đóng vai trò như sau:
- Nguyên tử sắt là chất khử (sự oxi hóa nguyên tử sắt)
- Số oxi hóa của đồng giảm từ +2 xuống 0 (ion đồng là chất oxi hóa)
=> Kết luận: Phản ứng này được gọi là phản ứng oxi hóa – khử vì tồn tại đồng thời về sự oxi hóa và sự khử.
Tham khảo thêm:
- Cách nhận biết phản ứng oxi hóa khử
- Cách cân bằng phản ứng oxi hóa khử nhanh, chính xác nhất
- Đặc điểm phản ứng oxi hoá khử và những kiến thức cần biết
2. Dấu hiệu nhận biết phản ứng oxi hóa khử là gì?
Phản ứng oxi hóa khử trong đời sống được thể hiện thông qua quá trình hô hấp của thực vật. Chúng hấp thụ khí cacbonic, giải phóng oxi và hàng loạt các quá trình trao đổi khác.
Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin đều là quá trình oxi hóa khử
Ngoài ra, hàng loạt các quá trình sản xuất luyện kim, chất dẻo, dược phẩm, phân bón hóa học,.. đều là biểu hiện của sự oxi hóa – khử.
3. Các bước viết phương trình phản ứng oxi hóa khử
Bước 1: Đầu tiên cần phải xác định được số oxi hóa của các nguyên tố để xác định chất nào là oxi hóa chất nào là khử.
Bước 2: Thực hiện viết phương trình oxi hóa và quá trình khử, cân bằng phương trình phản ứng
Bước 3: Ghi hệ số của các chất oxi hóa và chất khử vào sơ đồ phản ứng và cân bằng phương trình.
4. Các phản ứng oxi hóa khử
- Phản ứng oxi hóa – khử thông thường: Phản ứng oxi hóa sẽ tồn tại ở hai phân ử các chất khác nhau
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O
Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
- Phản ứng oxi hóa – khử nội phân: Phản ứng mà các chất khử và chất oxi hóa khử thuộc cùng 1 phân tử nhưng ở 2 nguyên tử khác nhau
AgNO3 → Ag + NO2 + O2
Cu(NO3)2 → CuO + NO2 + O2
- Phản ứng oxi hóa – khử tự nhiên: Phản ứng này chất khử cũng đồng thời là chất oxi hóa
Cl2 + 2KOH → KCl + KClO + H2O
4KClO3 → 3KClO4 + KCl
5. Ví dụ về phản ứng oxi hóa khử lớp 10
5.1. Ví dụ trong phản ứng oxi hóa khử Al + HNO3
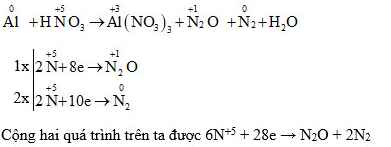
Trong phương trình phản ứng oxi hóa – khử Al + HNO3 hãy xác định số oxi hóa của các nguyên tử thay đổi
5.2. Ví dụ trong phản ứng oxi hóa khử KMnO4

Trong phương trình phản ứng oxi hóa – khử KMnO4 + HCl, hãy xác định số oxi hóa của các nguyên tử thay đổi.
5.3. Ví dụ trong phản ứng oxi hóa khử Cu + H2SO4

Trong phương trình phản ứng oxi hóa – khử Cu + H2SO4, hãy xác định số oxi hóa của các nguyên tử thay đổi.
Tham khảo thêm:
- Phản ứng thế là gì? Kiến thức cơ bản về phản ứng thế
- Định luật bảo toàn khối lượng và những kiến thức liên quan
6. 5 Bài phản ứng oxi hóa khử lớp 10
Bài tập 1: Cho các phương trình phản ứng sau đây, hãy xác định đâu là phản ứng oxi hóa khử
A: 2HgO 2Hg + O2
B: CaCO3CaO + CO2
C: 2Al(OH)3Al2O3+ 3H2O
D: 2NaHCO3Na2CO3+ CO2+ H2O
Lời Giải: Đáp án đúng là A, các đáp án khác không phải phản ứng oxi hóa khử.
2HgO 2Hg + O2.
Hg2+ + 2e → Hg0
2O2- → O2 + 4e
Bài tập 2: Cho các phương trình phản ứng sau đây, hãy xác định ở phản ứng nào NH3 đóng vai trò là chất khử
A: 4NH3+ 5O2→ 4NO + 6H2O.
B: 2NH3 + 3Cl2→ N2+ 6HCl.
C: 2NH3 + 3CuO → 3Cu + N2+ 3H2O.
D: 2NH3 + H2O2+ MnSO4→ MnO2+ (NH4)2SO4.
Lời Giải: Đáp án đúng là D, do N không thay đổi số oxi hóa trước và sau phương trình phản ứng
Bài tập 3: Cho các phương trình phản ứng sau đây, hãy xác định phản ứng nào là phản ứng oxi hóa -khử
A: HNO3 + NaOH → NaNO3 + H2O.
B: N2O5+ H2O → 2HNO3.
C: 2HNO3+ 3H2S → 3S + 2NO + 4H2O.
D: 2Fe(OH)3 → Fe2O3+ 3H2O.
Lời Giải: Đáp án đúng là C, các đáp án khác không phải phản ứng oxi hóa khử.
Bài tập 4: Thế nào là phản ứng oxi hóa – khử, cho 3 ví dụ
Lời Giải: Phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự chuyển đổi electron giữa các chất trong phản ứng
Ví dụ:
H2 + Cl2 -> 2HCl
Fe + 2HCl -> FeCl + H2
FeCl2 + Cl2 -> 2FeCl3
Bài tập 5: Phải cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85ml dung dịch AgNO3 0,15M.
Lời Giải:
VAgNO3 = 85 ml = 85/1000 lít
-> Cm = n/V => n = (0,15 x 85)/1000 = 0,01275 mol
Phương trình phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Theo phương trình ta có:
nCu = ½ nAgNO3 = 0,01275/2 = 0,006375 mol
Vậy mCu = 0,006375 x 64 = 0,408g.
Ngoài ra, còn rất nhiều dạng bài phản ứng oxi hóa khử lớp 10 nâng cao khác, tùy vào từng đề bài mà chúng ta đưa ra phương án phù hợp.
Hy vọng rằng, với những chia sẻ vừa rồi về phản ứng oxi hóa khử là gì? Ví dụ về phản ứng oxi hóa khử lớp 10 và một số bài tập thường gặp trên đây sẽ giúp cho các bạn học sinh vận dụng vào làm bài tập hiệu quả nhất. Tham khảo thêm các dạng bài tập hóa học khác tại website giaoduchocduong24h.net. Hãy chia sẻ bài viết nếu bạn thay hay và hấp dẫn.








 Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
