Nếu bạn đã từng học môn Hóa thì chắc hẳn cũng đã nghe đến định luật bảo toàn khối lượng. Đây được coi là nội dung kiến thức cơ bản nhất trong chương trình hóa học, nó là nền tảng căn bản để giúp bạn có thể chinh phục được những bài toán khó. Vì vậy, bài viết sau đây chúng tôi sẽ thông tin đến bạn toàn bộ nội dung lý thuyết quan trọng có liên quan đến định luật này.
Ai là người phát hiện ra định luật bảo toàn khối lượng ?
Định luật bảo toàn khối lượng trong hóa học là nội dung nói về khối lượng của các chất hóa học trước và sau khi phản ứng có giá trị như nhau. Đây chỉ là những kiến thức cơ bản nhưng nó lại có vai trò vô cùng lớn trong việc hỗ trợ bạn giải những bài toán hóa học.
Định luật hóa học này được ra đời bởi hai nhà khoa học nổi tiếng đó là M.V.Lomonosov (1711- 1765) cùng với đó là Antoine Lavoisier (1743 – 1794). Họ đã tiến hành độc lập các thí nghiệm của mình và tìm ra được định luật này.
M.V.Lomonosov sau khi thực hiện việc cân bình nút khí đựng bột kim loại trước và sau khi tiến hành quá trình nung ông đã nhận ra rằng khối lượng của chúng không có sự thay đổi mặc dù đã có phản ứng hóa học xảy ra. Một thời gian sau ông đã áp dụng phương pháp định lượng nghiên cứu với các phản ứng hóa học và đến năm 1748 ông đã chính thức tìm ra được định luật này.
Và mãi cho đến năm 1789 thì nhà hóa học Antoine Lavoisier (người Pháp) đã có những phát biểu về định luật này. Giới khoa học sau này đã công nhận định luật bằng cách đặt tên theo hai nhà khoa học đã đưa ra định đề và phát biểu định luật.
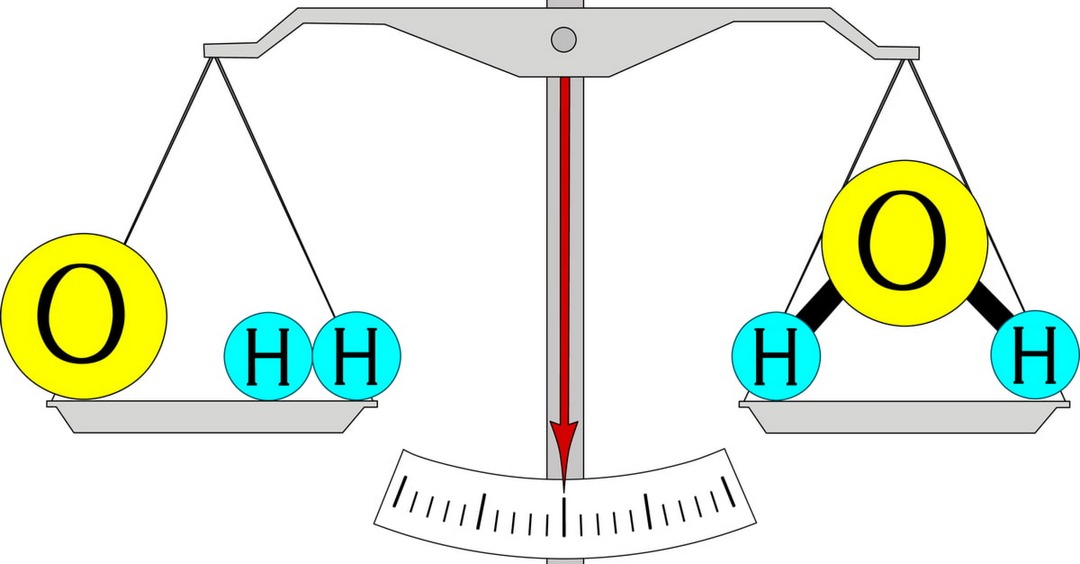
Giải thích định luật về bảo toàn khối lượng
Nội dung của định luật này đã được phát biểu như sau: “Trong một phản ứng hóa học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng”. Khi đã hiểu được nội dung định luật thì chúng ta cũng nên giải thích được nó.
Theo đó, định luật này được giải thích rằng khi mỗi phản ứng hóa học diễn ra thường sẽ chỉ có sự thay đổi ở liên kết giữa các nguyên tử. Sự thay đổi này chủ yếu là do các electron gây ra. Chính vì lý do đó mà số nguyên tử trong mỗi nguyên tố thường sẽ được giữ nguyên và khối lượng nguyên tử sẽ không bị thay đổi. Chính vì đó nên khối lượng của các chất trước và sau phản ứng thường sẽ được bảo toàn.
Định luật bảo toàn này trong một số trường hợp còn được gọi là “định luật bảo toàn về khối lượng của các chất”. Bởi người ta giải thích rằng, trong cùng một thời điểm thì khối lượng và trọng lượng sẽ tỷ lệ thuận với nhau.
Hướng dẫn cách tính định luật bảo toàn khối lượng
Dựa vào những định nghĩa của định luật đã được chia sẻ bên trên thì chúng ta có thể dễ dàng trong việc áp dụng và tìm ra cách tính nó. Giả sử, trong trường hợp 2 chất A và B phản ứng với nhau và tạo ra 2 chất mới là C và D. Lúc này, khi áp dụng định luật ta sẽ có được tổng khối lượng của 2 chất A+B sẽ bằng với tổng khối lượng 2 chất C+D. Công thức thu gọn của nó sẽ được viết là mA+mB = mC+mD.
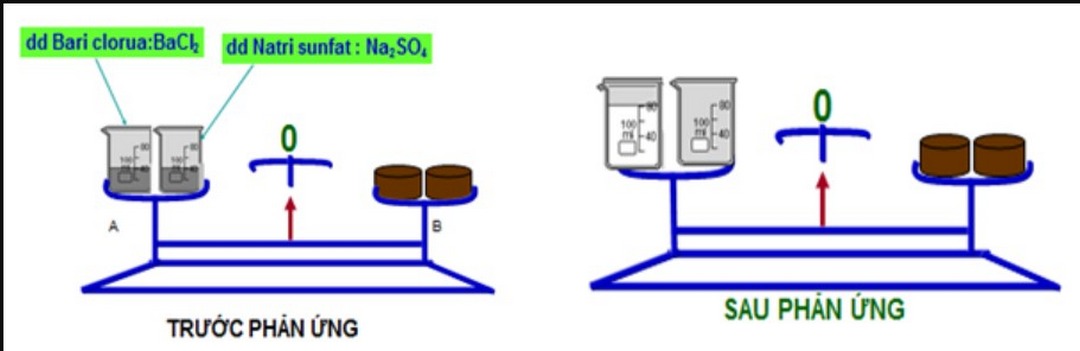
Để giúp bạn có được một cái nhìn rõ nét nhất thì hãy cùng chúng tôi đến với một ví dụ cụ thể sau đây. Ví dụ trong phản ứng hóa học giữa bari clorua khi tác dụng với natri sunfat sẽ tạo ra được 2 chất hoàn toàn mới đó là natri clorua và bari sunfat (phương trình hóa học của phản ứng sẽ là BaCl2 + Na2SO4 → NaCl + BaSO4). Như vậy, lúc này ta sẽ có công thức bảo toàn khối lượng như sau:
mBaCl2 + mNa2SO4 = mNaCl + mBaSO4
Với kiến thức này, ta có thể áp dụng vào những bài tập phản ứng có n chất và nó đã cho khối lượng của (n-1) chất. Như vậy, từ đó ta có thể dễ dàng tìm được khối lượng của chất còn lại.
Bảo toàn khối lượng được áp dụng như thế nào ?
Với định luật về bảo toàn khối lượng này chúng ta có thể sử dụng nó để giải quyết rất nhiều bài tập hóa học khác nhau. Sau đây, hãy cùng chúng tôi đi khám phá những dạng bài tập có thể áp dụng được định luật này để giải:
Dạng 1: Dạng bài tập lý thuyết về định luật bảo toàn khối lượng
Với dạng bài này, bạn cần phải nắm chắc khái niệm liên quan đến định luật. Thêm vào đó là phải giải thích được vì sao trong 1 phản ứng hóa học bất kỳ thì tổng khối lượng các chất và sau phản ứng là bằng nhau.
Dạng 2: Dạng về áp dụng công thức tính bảo toàn khối lượng
Đây là dạng bài vô cùng cơ bản, thường để bài sẽ cho bạn sẵn khối lượng của (n-1) chất trong tổng số n chất. Khi gặp dạng này bạn chỉ cần áp dụng đúng công thức mA+mB+….= mC+mD+…. Là có thể dễ dàng tìm được khối lượng của chất còn lại.
Dạng 3: Vận dụng công thức cùng với viết phương trình để giải
Dạng bài này nâng cao hơn một chút, nó yêu cầu bạn cần phải viết được phương trình phản ứng hóa học xảy ra. Giả sử, đề bài cho 9 gam Mg đốt trong không khí để tạo ra 15 gam MgO. Như vậy, bạn phải viết được phương trình các chất phản ứng và sau phản ứng thì việc tính toán mới có thể dễ dàng thực hiện.

Dạng 4: Tính khối lượng các chất tham gia/ tạo thành
Trong dạng này, người ta thường sẽ cho bạn khối lượng của các chất tham gia/sản phẩm để từ đó yêu cầu tính khối lượng các chất còn lại. Ví dụ, đề bài cho nung đá dolomit thu được 104 kg hai oxit và 88 kg khí C02 và yêu cầu tính khối lượng đá đã lấy để nung.
Dạng 5: Xác định khối lượng chất thành phần khi có yêu cầu đính kèm
Trong một số bài tập bạn sẽ không thể áp dụng được định luật ngay mà cần phải thực hiện thêm một số thao tác tính toán. Ví dụ bài tập khi đem đốt m(g) Mg trong không khí và thu được 8g MgO. Với khối lượng của Mg gấp đôi khối lượng của Oxi và yêu cầu tính khối lượng Mg.
Ý nghĩa của định luật bảo toàn khối lượng
Từ khi bảo toàn khối lượng được ra đời đã giúp cho rất nhiều vấn đề được giải quyết một cách nhanh gọn. Cụ thể như:
- Định luật này giúp cho ta biết được rằng trong mỗi phản ứng hóa học thường sẽ chỉ có sự thay đổi chủ yếu ở điện tử còn số nguyên tử của các nguyên tố thì được giữ nguyên.
- Với những bài toán hóa học nhiều chất, nếu như không áp dụng phương pháp này thì dường như chúng ta rất khó để có thể giải quyết được nó. Tuy nhiên, khi có định luật thì đây lại trở thành những bài toán đơn giản, dễ ăn điểm.
- Định luật này giúp cho chúng ta có thể giải nhanh được những bài toán phức tạp nếu như biết được sự liên hệ giữa các chất trước và sau khi phản ứng hóa học xảy ra.
- Thường các phản ứng hóa học sẽ không đạt hiệu suất 100% nên các chất trước phản ứng thường sẽ không được phản ứng hoàn toàn. Với trường hợp này thì để giải thủ công thì sẽ vô cùng phức tạp, nhưng nếu sử dụng định luật này áp dụng cùng một vài phương pháp giải đặc biệt khác sẽ giúp bài toán trở nên đơn giản hơn rất nhiều.
Hướng dẫn giải một số bài tập bằng định luật bảo toàn khối lượng
Với những lý thuyết trên, nếu không được áp dụng vào những bài tập cụ thể thì chúng ta sẽ rất khó để có thể hình dung được cách làm. Vậy thì sau đây hãy cùng chúng tôi đến với một số bài tập có áp dụng định luật này nhé!
Bài tập 1
Đề bài: Nung 10g CaCO3 trong nhiệt độ cao thì thu được 3,8 gam khí CO2 và m gam CaO. Yêu cầu hãy viết phương trình phản ứng hóa học xảy ra và tính khối lượng CaO tạo thành.
Như vậy, để có thể giải được bài tập này thì trước hết chúng ta sẽ xác định phương trình phản ứng được thực hiện: CaCO3 → CO2 + CaO. Như vậy, có thể thấy rằng chỉ có 1 chất tham gia chúng ta sẽ thu được 2 sản phẩm mới.
Vậy, áp dụng ĐLBTKL ta được: mCaCO3= mCO2 + mCaO. Suy ra, mCaO=mCaCO3 – mCO2 = 10 – 3.8 = 6.2. Như vậy, sau phản ứng hóa học xảy ra ta sẽ thu được 6.2 gam CaO.

Bài tập 2
Đề bài: Khi cho natri sunfat (Na2SO4) phản ứng với bari clorua (BaCl2) tạo ra hai sản phẩm mới là Bari sunfat và natri clorua. Với khối lượng của Na2SO4 tham gia phản ứng là 14,2. Khối lượng của BaSO4 và NaCl lần lượt là 23,3 và 11,7. Đề bài yêu cầu tính khối lượng của BaCl2 đã tham gia phản ứng
Như vậy, có thể thấy đây là một dạng bài tập tương đối cơ bản, chúng ta chỉ cần áp dụng bảo toàn khối lượng là đã có thể tìm ra được khối lượng của BaCl2 đã tham gia phản ứng. Với mBaCl2 = mBaSO4 + mNaCl – mNa2SO4 = 23.3 + 11.7 – 14.2 = 20.8. Như vậy, khối lượng của BaCl2 đã tham gia phản ứng bằng 20.8 gam.
Bài tập 3
Người ta thường điều chế oxi bằng cách sử dụng chất kali clorat. Khi thực hiện đun nóng 24,5g chất này thì chất rắn còn lại có trong ống nghiệm là 13.45. Biết hiệu suất là 80%. Tính khối lượng oxi tạo ra.
Với hiệu suất là 80% thì khối mà KClO3 đã phản ứng là 24,5×80%=19.6gam. Đến đây, tương tự như các bài tập trước thì ta có thể áp dụng bảo toàn khối lượng để thực hiện tính toán. Với mO2 = mKClO3 – mKCL = 6.15 gam.
Như vậy, qua những bài tập trên chúng ta có thể thấy việc áp dụng bảo toàn khối lượng vào giải các bài toán khiến cho bài toán trở nên đơn giản hơn rất nhiều. Có thể thấy đây là một phương pháp vô cùng hữu hiệu đối với người học.
Kết luận
Như vậy, với nội dung bài viết trên đây chúng tôi đã giúp bạn có được một cái nhìn toàn diện nhất về định luật bảo toàn khối lượng. Chúc bạn có thể thành thạo trong việc áp dụng nó vào quá trình giải các bài toán hóa học. Nếu bạn vẫn còn những băn khoăn về định luật này thì đừng quên để lại thắc mắc để được chúng tôi hỗ trợ giải đáp nhé!








 Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
