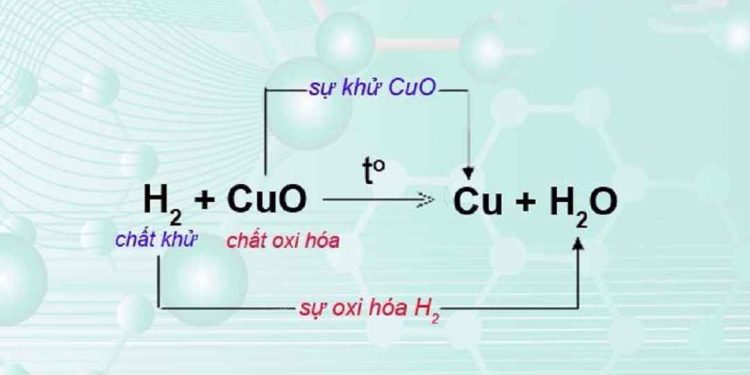
Trước khi tìm hiểu làm thế nào để xác định phản ứng Redox, người ta phải hiểu ý nghĩa của phản ứng Redox. Phản ứng oxi hóa khử được coi là phản ứng chuyển electron. Nó được bao gồm trong cả Hóa hữu cơ và Hóa vô cơ. Nó có tên là ‘Redox, vì phản ứng oxi hóa khử bao gồm phản ứng oxy hóa và phản ứng khử. Xác định số oxi hóa là điểm quan trọng trong việc xác định phản ứng oxi hóa khử.
Bài viết này thảo luận về các loại phản ứng oxi hóa khử, Cách nhận biết phản ứng oxi hóa khử và đưa ra ví dụ cho mỗi phản ứng oxi hóa khử, một nửa phản ứng trong phản ứng oxi hóa khử và cũng giải thích các quy tắc trong việc xác định số oxi hóa và sự thay đổi số oxy hóa.
Phản ứng oxi hóa khử là gì
Phản ứng gốc axit được đặc trưng bởi một quá trình chuyển proton, tương tự phản ứng oxy hóa – khử hoặc oxi hóa khử liên quan đến quá trình chuyển điện tử. Phản ứng oxi hóa khử có hai nửa phản ứng, đó là phản ứng oxi hóa và phản ứng oxi hóa. Phản ứng oxy hóa liên quan đến việc mất electron và phản ứng khử liên quan đến sự chấp nhận electron. Do đó, một phản ứng oxi hóa khử có hai loài, tác nhân oxy hóa trải qua phản ứng nửa oxi hóa và chất khử trải qua phản ứng nửa khử. Mức độ giảm trong phản ứng oxi hóa khử tương đương với mức độ oxy hóa; điều đó có nghĩa là, số electron bị mất từ tác nhân oxy hóa bằng với số electron được chấp nhận bởi chất khử. Đó là một quá trình cân bằng về mặt trao đổi điện tử.
Tham khảo thêm:
- Phản ứng oxi hóa khử là gì? Ví dụ về phản ứng oxi hóa khử
- Cách cân bằng phản ứng oxi hóa khử nhanh, chính xác nhất
- Tổng hợp các dạng phản ứng oxi hóa khử và phương pháp cân bằng
Cách nhận biết phản ứng oxi hóa khử
Tìm số oxi hóa
Để xác định phản ứng oxi hóa khử, trước tiên chúng ta cần biết trạng thái oxy hóa của từng nguyên tố trong phản ứng. Chúng tôi sử dụng các quy tắc sau để gán số oxy hóa.
Các phần tử tự do, không kết hợp với các phần tử khác, có số oxi hóa bằng không. Do đó, các nguyên tử trong H2, Br2, Na, Be, Ca, K, O2 và P4 có cùng số oxi hóa bằng không.
Đối với các ion chỉ gồm một nguyên tử (các ion đơn sắc), số oxi hóa bằng với điện tích trên ion. Ví dụ:
Na+, Li+ và K+ có số oxi hóa +1.
F–, Tôi–, Cl– và Br– có số oxi hóa -1.
Ba2+, Ca2+, Fe2+ và Ni2+ có số oxi hóa +2.
Ôi2- và S2- có số oxi hóa -2.
Al3+ và Fe3+ có số oxi hóa +3.
• Số oxy hóa phổ biến nhất của oxy là -2 (O2-: MgO, H2O), nhưng trong hydro peroxide, nó là -1 (O22- : H2Ôi2).
Số oxi hóa phổ biến nhất của hydro là +1. Tuy nhiên, khi liên kết với kim loại ở nhóm I và nhóm II, số oxi hóa là -1 (LiH, NaH, CaH2).
• Fluorine (F) chỉ hiển thị trạng thái oxy hóa -1 trong tất cả các hợp chất của nó, các halogen khác (Cl–, Br– và tôi–) có cả số oxi hóa âm và dương.
• Trong một phân tử trung tính, tổng của tất cả các số oxy hóa bằng không.
Trong một ion đa nguyên tử, tổng của tất cả các số oxi hóa bằng với điện tích trên ion.
• Số oxi hóa không cần chỉ là số nguyên.
Ví dụ: ion Superoxide (O22-) – Oxy có trạng thái oxy hóa -1/2.

Xác định phản ứng oxy hóa và phản ứng khử:
Xét phản ứng sau.
2Ca + O2 (g) -> 2CaO (s)
Bước 1: Xác định chất oxi hóa và chất khử. Đối với điều này, chúng ta cần xác định số oxy hóa của chúng.
2Ca + O2(g) -> 2CaO (s)
0 0 (+2) (-2)
Cả hai chất phản ứng có số oxi hóa bằng không. Canxi làm tăng trạng thái oxy hóa của nó từ (0) -> (+2). Do đó, nó là tác nhân oxy hóa. Ngược lại, trong Oxy trạng thái oxy hóa giảm từ (0) -> (-2). Do đó, Oxy là chất khử.
Cách nhận biết phản ứng oxi hóa khử
Tham khảo thêm:
- Phản ứng thế là gì? Kiến thức cơ bản về phản ứng thế
- Định luật bảo toàn khối lượng và những kiến thức liên quan
Các loại phản ứng oxi hóa khử
Có bốn loại phản ứng oxi hóa khử khác nhau: phản ứng kết hợp, phản ứng phân hủy, phản ứng chuyển vị và phản ứng không cân xứng.
Phản ứng kết hợp:
Phản ứng kết hợp là những phản ứng trong đó hai hoặc nhiều chất kết hợp với nhau tạo thành một sản phẩm duy nhất.
A + B -> C
S (s) + O2(g) -> SO2(g)
S (0) O (0) S (+4), O (-2)
3 Mg (s) + N2(g) -> Mg3 N2(S)
Mg (0) N (0) Mg (+2), N (-3)
Phản ứng phân hủy:
Trong các phản ứng phân hủy, một hợp chất bị phá vỡ thành hai trong số các thành phần. Nó là đối nghịch của các phản ứng kết hợp.
C -> A + B
2HgO (s) -> 2Hg (l) + O2(g)
Hg (+2), O (-2) Hg (0) O (0)
2 NaH (s) Đầm-> 2 Na (s) + H2 (g)
Na (+1), H (-1) Na (0) H (0)
2 KClO3(s) -> 2KCl (3) + 3O2(g)
Phản ứng dịch chuyển:
Trong phản ứng chuyển vị, một ion hoặc nguyên tử trong hợp chất được thay thế bằng ion hoặc nguyên tử của hợp chất khác. Phản ứng dịch chuyển có một loạt các ứng dụng trong công nghiệp.
A + BC -> AC + B
Sự dịch chuyển hydro:
Tất cả các kim loại kiềm và một số kim loại kiềm (Ca, Sr và Ba) thay thế bằng hydro từ nước lạnh.
2Na + 2H2O (l) -> 2NaOH (aq) + H2(g)
Ca (s) + 2H2O (l) -> Ca (OH)2 (aq) + H2(g)
Chuyển vị kim loại:
Một số kim loại ở trạng thái nguyên tố có thể thay thế kim loại trong hợp chất. Ví dụ, Kẽm thay thế các ion Đồng và Đồng có thể thay thế các ion Bạc. Phản ứng dịch chuyển phụ thuộc vào chuỗi hoạt động của địa điểm (hoặc chuỗi điện hóa).
Zn (s) + CuSO4(aq) -> Cu (s) + ZnSO4(aq)
Sự dịch chuyển của halogen:
Chuỗi hoạt động cho các phản ứng chuyển vị halogen: F2 > Cl2 > Br2 > Tôi2. Khi chúng ta đi xuống loạt halogen, sức mạnh của khả năng oxy hóa giảm.
Cl2(g) + 2KBr (aq) -> 2KCl (aq) + Br2(l)
Cl2(g) + 2KI (aq) -> 2KCl (aq) + I2(S)
Br2(l) + 2I– (aq) -> 2Br–(aq) + Tôi2(S)
Phản ứng không cân xứng:
Đây là một loại đặc biệt của phản ứng oxi hóa khử. Một nguyên tố trong một trạng thái oxy hóa đồng thời bị oxy hóa và khử. Trong phản ứng không cân xứng, một chất phản ứng phải luôn chứa một nguyên tố có thể có ít nhất ba trạng thái oxy hóa.
2 giờ2Ôi2(aq) -> 2H2O (l) + O2(g)
Ở đây số oxi hóa trong chất phản ứng là (-1), nó tăng lên 0 trong O2 và giảm xuống (-2) trong H2O. Số oxi hóa trong hydro không thay đổi trong phản ứng.
Cách xác định một phản ứng Redox
Phản ứng oxi hóa khử được coi là phản ứng chuyển electron. Trong phản ứng oxi hóa khử, một nguyên tố bị oxi hóa và nó giải phóng electron và một nguyên tố đang giảm bằng cách thu được các electron được giải phóng. Mức độ oxy hóa tương đương với mức độ giảm về mặt trao đổi điện tử trong phản ứng. Có hai nửa phản ứng trong phản ứng oxi hóa khử; chúng được gọi là phản ứng nửa oxi hóa và phản ứng nửa khử. Có sự gia tăng số oxy hóa trong quá trình oxy hóa, tương tự như số oxy hóa giảm trong quá trình khử.
Trên đây là Cách nhận biết phản ứng oxi hóa khử bạn có thể tham khảo. Hy vọng những kiên sthuwcs này sẽ giúp ích cho bạn.








 Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
Để xây dựng kiến thức học đường trong môi trường hiện nay cần phải có sự tác động nhiều chiều, từ nhiều chủ thể khác nhau.
Cùng theo dõi giaoduchocduong24h.net để có những thông tin đáng đọc nhé.
